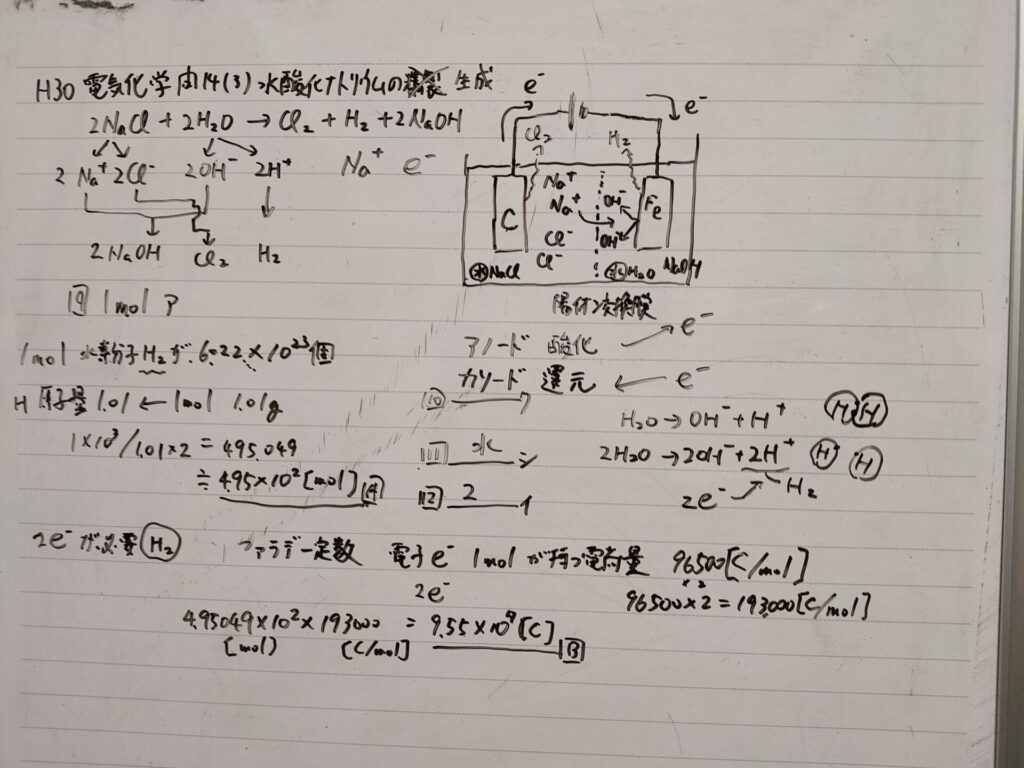
(3) 化学工業の基礎材料である塩素、水酸化ナトリウム(苛性ソーダ)は、次の反応式で表される食塩水の電気分解を利用して生成される。
\[2 NaCl + 2H_2O → Cl_2 + H_2 + 2NaOH\]
この反応で、\(1 mol\) の水酸化ナトリウムが生成されるのに必要な電子は、\(\fbox{9}[mol]\) である。 また、この反応では同時に水素も生成される。 水素は電解槽の中の\(\fbox{10}\)で\(\fbox{11}\)が還元されて生成されるが、\(1 mol\)の水素が生成されるのに必要な電子は\(\fbox{12}[mol]\) である。
ここで、\(Na\)の原子量が \(23.0\)、\(O\)の原子量が \(16.0\)、 \(H\)の原子量が \(1.01\) であり、ファラデー定数が\(96500[C/mol]\) であるとすると、水素\(1kg\) は、\(\fbox{A}[mol]\) であるので、水素 \(1kg\) を製造 するのに必要な理論電気量は、\(\fbox{B}[C]\)となる。
ア 1 イ 2 ウ 3 エ 4 オ 5 カ 6
キ アノード ク カソード ケ 塩化ナトリウム
コ 水酸化ナトリウム サ 電解質 シ 水


コメント